

作者:维尔克斯 时间:2022-7-13 8:59:52
德国Marzhauser公司(MW)是一家专注于显微镜电动载物台领域和手动载物台领域的先进OEM制造商,他们的主要产品有电动/手动载物台、轴控制器、载物台嵌入器、显微操作器、电子控制器等,这篇文章主要介绍了Marzhauser的产品在细胞科研中的前沿科学应用,如:倒置显微镜载物台、机械化样品台、聚焦驱动器和Marzhauser Wetzlar显微镜电动平台。国际顶级期刊Cell和Cancer Cytopathology均有相关文献。
MarzhauserWetzlar在检测FRET的应用
Cell的一篇文章报道了MW显微镜电动平台在检测FRET的应用,文章名为Ramuz, M.; Hasan, A.; Gruscheski, L.; Diakonov, I.; Pavlaki, N.; Nikolaev, V.O.; Harding, S.; Dunsby, C.; Gorelik, J. A Software Tool for High- Throughput Real-Time Measurement of Intensity-Based Ratio-Metric FRET. Cells 2019, 8, 1541.
伦敦帝国理工学院Imperial College London发表的这篇文章的中文标题可以翻译为:基于强度的比率度量 FRET 的高通量实时测量软件工具。Förster共振能量转移(FRET)越来越多地用于活细胞中荧光标记分子的非侵入性测量。 在这项研究中,我们开发了一个免费提供的软件工具MultiFRET,它与电动显微镜载物台的使用一起,允许在一个实验中研究多个单细胞。MultiFRET是Micro-Manager软件的Java插件,可在采集过程中实时计算比率度量信号,并可在同一实验中同时记录多个细胞。它还可以进行其他自定义的实时计算,这些计算可以在实验结束时轻松导出到Excel。它很灵活,可以与多个光谱采集通道一起工作。我们通过将MultiFRET的输出与先前建立且有据可查的实时比率度量FRET实验方法的输出进行比较来验证该软件,并发现使用新的MultiFRET和其他方法产生的数据之间没有显着差异。在此验证中,我们使用了几种cAMPFRET传感器和细胞模型:i)从表达胞质epac1-camps和靶向pmEpac1和Epac1-PLN传感器的转基因小鼠中分离出成年心肌细胞,ii)用AKAP79-CUTie传感器转染分离的新生小鼠心肌细胞和iii)用Epac-S转染的人诱导多能干细胞衍生的心肌细胞(hiPSC-CM)H74传感器。MultiFRET插件是一个免费的开源软件包,当需要实时比率度量计算时,可用于广泛的活细胞成像。
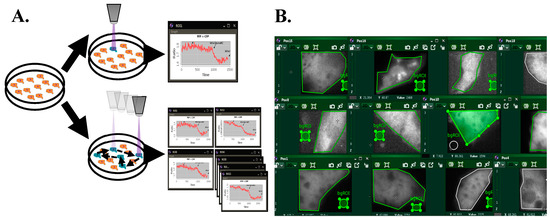
我们的显微镜系统基于JUSprenger等人所示的相同原理。但增加了MW显微镜电动平台和聚焦驱动器(MärzhäuserWetzlar,德国),允许在一次实验中获得更高吞吐量的多个视场(FOV)。实验前在Micro-Manager中记录单个细胞位置(X、Y和Z),从而使每个图像捕获都以细胞为中心并聚焦。使用带有Nikon60x/1.40PlanApo物镜、430nmLED光源(CairnResearch,Faversham,KentUK)和长通455nm二向色镜(DM455,Omega,Brattleboro,美国佛蒙特州)。反射光通过分束器QuadView(Photometrics,Tucson,AZ,USA)在到达相机之前将光分成四个通道。
MW自动平台检测ROS1阳性的非小细胞肺癌的应用
Cancer Cytopathology的一篇文章报道了MW显微镜自动平台在检测FRET的应用,文章名为Vlajnic, T., Savic, S., Barascud, A., Baschiera, B., Bihl, M., Grilli, B., Herzog, M., Rebetez, J. and Bubendorf, L. (2018), Detection of ROS1-positive non-small cell lung cancer on cytological specimens using immunocytochemistry. Cancer Cytopathology, 126: 421-429.
巴塞尔大学医院University Hospital Basel发表的这篇文章的中文标题可以翻译为:检测使用免疫细胞化学对细胞学标本进行 ROS1 阳性非小细胞肺癌。我们在1%到2%的非小细胞肺癌(NSCLC)中发现ROS1肿瘤基因的重排,并认为这是相互排斥的致癌驱动突变。自从ROS1阳性NSCLC的靶向治疗被批准后,ROS1检测已成为诊断常规的一部分。荧光原位杂交(FISH),可选择对组织学材料进行免疫组化,是检测ROS1重排的常见做法。然而,NSCLC往往只通过细胞学诊断,需要对细胞学标本进行预测性标记物检测。在目前的研究中,作者探讨了ROS1免疫细胞化学(ICC)在非细胞块细胞学标本上检测ROS1重排的准确性。
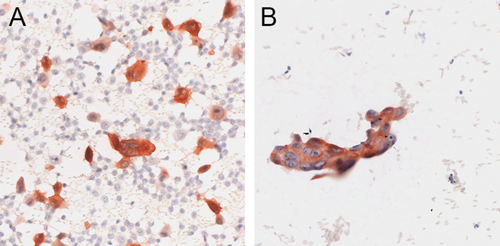
研究人群的大多数诊断性FISH分析(82例中的78例;95%)是对固定在Delaunay溶液中并按照Papanicolaou方法染色的细胞学标本或以前使用AEC作为发色剂的ICC染色标本进行的。在有罕见的癌细胞或与良性细胞强烈混合的情况下,使用搬迁软件(Metafer 4,MetaSystems,Baden-Wurttemberg,德国)和MW显微镜自动平台(Marzhauser,德国)记录细胞学涂片上癌细胞的确切位置,该平台安装在外照射显微镜(Axioplan 2 Imaging;Carl Zeiss,Oberkochen,德国)。在揭盖和杂交之前,用数码相机(AxioCam; Carl Zeiss)对癌细胞进行拍照,并用钻石笔在玻片上永久标记目标区域。然后使用市售的双色断裂探针进行FISH,探针为3′端(中心粒)绿色探针和5′端(端粒)橙色探针(ZytoVision, Bremerhaven, Germany),如前所述9。根据制造商的建议,在4μm厚的组织切片上对FFPE活检(82例中的4例)进行FISH。
Marzhauser显微镜电动平台在人骨髓基质细胞观察的应用
Cell的一篇文章报道了MarzhauserWetzlar显微镜电动平台在人骨髓基质细胞观察的应用,文章名为Batch Effects during Human Bone Marrow Stromal Cell Propagation Prevail Donor Variation and Culture Duration: Impact on Genotype, Phenotype and Function. Brachtl,G.; Poupardin,R.; Hochmann,S.; Raninger,A.; Jürchott,K.; Streitz,M.; Schlickeiser,S.; Oeller,M.; Wolf,M.; Schallmoser,K.; Volk,H.-D.; Geissler,S.;S trunk,D. Cells 2022,11,946.
帕拉塞尔苏斯医科大学Paracelsus Medical University (PMU)发表的这篇文章的中文标题可以翻译为:人骨髓基质细胞繁殖过程中的批处理效应,对供体变化和培养时间的影响:对基因型、表型和功能的影响。供体变异是一个十分常见的问题,它限制了细胞疗法的适用性。我们假设骨髓基质细胞(BMSCs)在人血小板裂解液(hPL)中繁殖时的批次效应时,取代胎牛血清(FBS),可以影响表型和功能的变异。因此,我们调查了供体变异、hPL与FBS驱动的繁殖和详尽的增殖对BMSC表观基因组、转录组、表型、凝血风险和骨软骨再生功能的影响。值得注意的是,在HPL中的繁殖明显增加了BMSC的增殖,创造了明显不同的基因表达轨迹和独特的表面标志物特征,这已经是在一个段落之后。我们证实在增殖挑战后,FBS扩增的BMSC的增殖潜力明显下降。流式细胞仪验证了培养扩增的BMSCs的典型成纤维细胞表型。我们观察到对DNA甲基化的影响有限,主要是在FBS驱动的培养物中,与培养时间无关。凝血风险随培养时间增加。此外,在异种血清中扩增导致三维软骨盘形成过程中功能明显丧失,凝血风险明显增加。在HPL-条件下,优越的软骨功能在培养过程中得以保持。血小板血型和异凝血素对BMSC功能的影响很小。这些数据表明,由于血清因素对BMSC转录组、表型和功能有明显的批次影响,仅在一个培养周期后就部分地超过了供体的变化。

我们将骨髓抽吸物被分成50/50,基质细胞被分离出来,并在动物无血清条件下用含有hPLO/AB的BMSC扩增培养基或用含有FBS的培养基进行扩增,我们冷冻保存了BMSC第0段(P°,初级培养结束时),供以后分析。对于大规模扩增,我们将细胞直接播种到四层细胞工厂(CF-4)中,在解冻后的BMSC扩增培养基中补充了hPLO/AB或FBS。从第1阶段(P1)开始,对扩大的BMSCs进行分析或在这些培养基中进一步培养,直到第4-5阶段(P4-5)。在hPLO/AB中P°培养的BMSCs的等分试样被转移到含有hPLmBG的BMSC扩增培养基中,同样培养至P4。对P1和P4的BMSCs进行进一步分析,在选定的实验中,由于不同样品的细胞生长情况不同,我们使用了P4+/-一个通道的样品。所有通道的BMSC群体倍增率(PD)用公式LN(倍增细胞数)/LN(2)计算。理论上的累积细胞数是通过假设所有的细胞都被进一步扩大来计算的,方法是将P1的全部收获的细胞与接下来在较小的培养容器中的P2-3阶段的倍增数相乘。为了量化细胞形态,来自供体一和二的细胞以10,000细胞/cm2的密度播种过夜,用Calcein(LIVE/DEAD™活力/细胞毒性试剂盒Thermo Fisher Scientific, Waltham, MA, USA)染色20分钟。在10倍放大率下,用倒置显微镜载物台(MärzhäuserWetzlar, Germany)的EclipseTi倒置显微镜(Nikon, Tokyo, Japan)在相衬和GFP通道下拍摄图像,作为四倍的视场。使用NISAR软件进行阈值处理后检测单个GFP+细胞。提取了1208-1428个单个细胞的包含面积和长度的物体数据并用于统计分析。