

作者:维尔克斯 时间:2022-7-15 9:16:33
德国MarzhauserWetzlar公司(MW)的Marzhauser显微镜电动平台能搭配市场上大多数的显微镜,其应用的领域非常广泛如:细胞科研,分子研究,化学和生物学领域等等。本篇文章主要描述了MW显微镜电动平台在生物学和化学领域中的应用。
MW显微镜电动平台在褪黑激素的实验中的应用
MDPI的一篇文章报道了MW显微镜电动平台在褪黑激素的实验中的应用,文章名为Oliveira-Abreu, K.; Silva-dos-Santos, N.M.; Coelho-de-Souza, A.N.; Ferreira-da-Silva, F.W.; Silva-Alves, K.S.d.; Cardoso-Teixeira, A.C.; Cipolla-Neto, J.; Leal-Cardoso, J.H. Melatonin Reduces Excitability in Dorsal Root Ganglia Neurons with Inflection on the Repolarization Phase of the Action Potential. Int. J. Mol. Sci. 2019, 20, 2611.
塞阿拉联邦大学(Universidade Estadual do Ceará)发表的这篇文章的中文标题可以翻译为:褪黑激素降低背根神经节神经元的兴奋性,影响动作电位的复极化阶段褪黑激素是一种在夜间由松果体产生和分泌的神经激素。褪黑激素的许多作用已经被描述过,例如。激活肾上腺核的钾离子通道和抑制背根神经节(DRG)的一个亚群神经元的兴奋性。DRG被描述为一个有几个神经元群的结构。一种分类方法是根据动作电位(AP)的复极化阶段,将DRG神经元分为两种类型。没有(N0)和有(Ninf)动作电位复极化阶段的拐点。我们以前已经证明褪黑激素抑制了N0神经元的兴奋性,在本工作中,我们旨在研究褪黑激素对DRG神经元群体的其他神经元(Ninf)的影响。这项调查是在电流钳模式下使用尖锐的微电极技术进行的。褪黑激素(0.01-1000.0 nM)对神经元的兴奋性显示出抑制活性,这可以通过阻断AP和增加流变基地来观察。然而,我们观察到,虽然有些神经元对褪黑激素对兴奋性的影响很敏感(兴奋性褪黑激素敏感-EMS),但其他神经元对褪黑激素对兴奋性的影响不敏感(兴奋性褪黑激素不敏感-EMNS)。关于神经元的被动电生理特性,褪黑激素在两种细胞类型中都引起了静止膜电位的超极化。关于输入电阻(Rin),褪黑激素没有改变EMS细胞的这个参数,但增加了EMNS细胞的值。褪黑激素还改变了EMS细胞的几个AP参数,最明显的变化是AP去极化的(dV/dt)最大值,这与褪黑激素对兴奋性的影响是一致的。否则,在EMNS细胞中,褪黑激素(0.1-1000.0nM)没有引起AP去极化的(dV/dt)最大值的改变。因此,把这些数据和以前发表的关于褪黑激素对N0神经元影响的数据结合起来,表明这种物质对Ninf神经元具有更大的药理作用。我们认为,褪黑激素具有与Ninf神经元有关的重要生理功能,这可能具有潜在的相关治疗作用,因为Ninf神经元与痛觉有关。
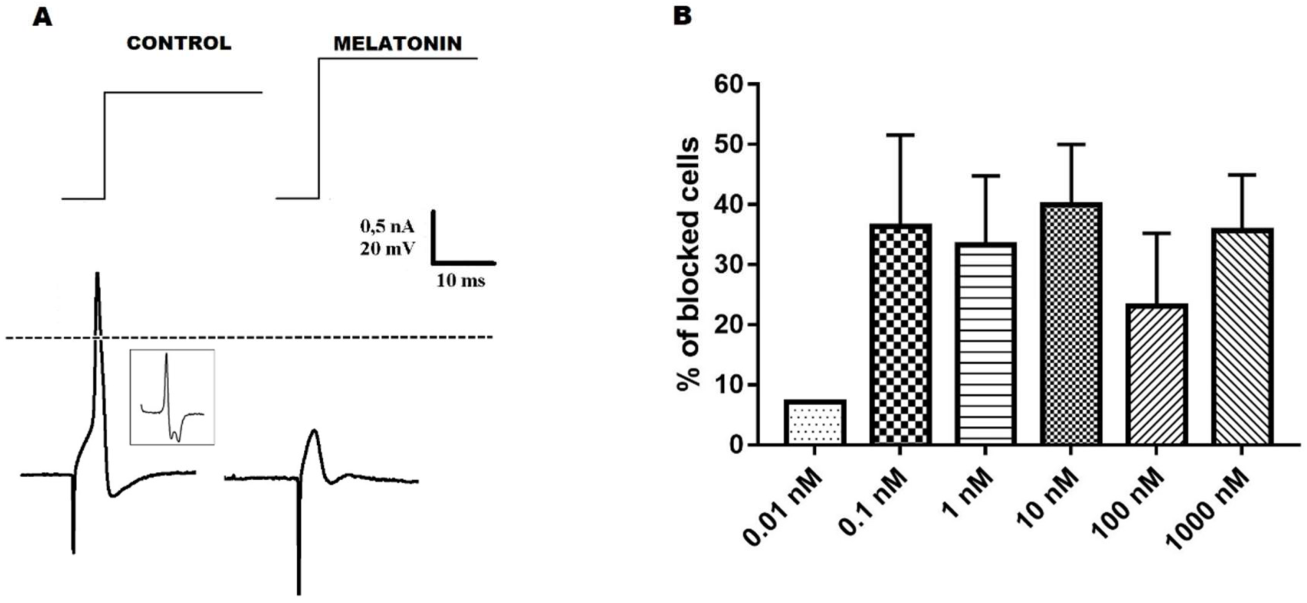
如前所述进行背根神经节神经元电特性的记录。解剖后的 DRG 立即置于 Locke 溶液中,并用 Sylgard 184 ®固定在丙烯酸室上在底部。通过重力通量维持超融合并调整至 1.0-1.5 mL/min。将腔室放置在立体显微镜(Model College Stereo,Germany)上,并使用显微镜电动平台(Model MS 314-Märzhäuser Wetzlar, Germany)进行微电极移动和穿刺。含有改良洛克和褪黑激素溶液的容器通过三通阀连接到腔室,三通阀可以在主容器和测试溶液之间快速切换。穿刺后,3-5 分钟后进行电生理记录,以稳定神经元膜的特性。神经元暴露于给定浓度或更少的褪黑激素长达 5 分钟,直到它阻断 AP。
MW显微镜载物台在红细胞研究中的应用
MDPI的一篇文章报道了MW显微镜自动平台在红细胞研究中的应用,文章名为Bardyn, M.; Allard, J.; Crettaz, D.; Rappaz, B.; Turcatti, G.; Tissot, J.-D.; Prudent, M. Image- and Fluorescence-Based Test Shows Oxidant -Dependent Damages in Red Blood Cells and Enables Screening of Potential Protective Molecules. Int. J. Mol. Sci. 2021, 22, 4293.
洛桑大学(Université de Lausanne)发表的这篇文章的中文标题可以翻译为:基于图像和荧光的测试显示红细胞中的氧化剂依赖性损伤并能够筛选潜在的保护性分子。在红细胞 (RBC) 的储存过程中,血袋内的氧饱和度增加和代谢失调发生。它导致红细胞抗氧化保护系统逐渐耗尽,从而导致氧化应激的有害状态,这种状态在所谓的储存损伤的显现中起主要作用。本研究描述了使用基于荧光和无标记形态读数的测试(称为 TSOX)来简单快速地评估各种化合物在受控条件下的氧化剂和抗氧化特性。在这里,将 TSOX 应用于用四种抗氧化剂(抗坏血酸、尿酸、trolox 和白藜芦醇)和三种氧化剂(AAPH、二酰胺和 H 2 O 2处理的红细胞)) 在不同浓度下。选择了两个互补的读数:首先,使用 DCFH-DA 荧光探针量化 ROS 的产生,其次,基于测量形态变化的数字全息显微镜。所有氧化剂都产生荧光增加,而 H 2 O 2没有明显影响红细胞形态。在四分之三的添加分子中观察到了显着的保护作用。值得注意的是,白藜芦醇诱导了菱形“Tirocytes”。选择的分析设计是灵活的,并且与高通量筛选兼容。在未来的实验中,TSOX 将用于筛选化学库和探针分子,这些分子可以添加到用于 RBC 存储的添加剂溶液中。
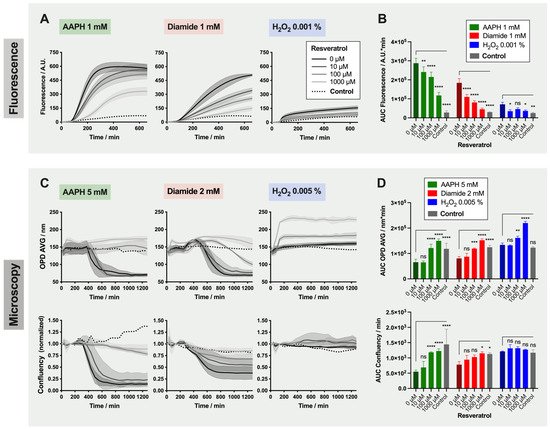
使用配备MW显微镜载物台 (Märzhäuser Wetzlar,Germany)、培养箱系统 ( LCI Live Cell Instrument,Seoul,South Korea)和20×/0.40NA物镜(Leica Microsystems GmbH,Wetzlar,Germany),如前所述。
如前所述,将红细胞放入CPD-SAGM RCC中并在0.9% NaCl中洗涤两次。然后将细胞沉淀重新悬浮在 HEPA 缓冲液中,并将每孔80'000个RBC (80 µL) 接种在涂有聚-L-鸟氨酸的 96 孔黑色成像板中。HEPA 缓冲液由 130 mM NaCl、5.4 mM KCl、1 mM CaCl 2 *2H 2 O、0.5 mM MgCl 2 *6H 2 O、10 mM 葡萄糖、15 mM Hepes 和 1 mg/mL BSA 组成。为了更快地沉淀细胞,将板轻轻离心(在室温下140× g2分钟)。然后,每孔加入 10 µL 抗氧化剂,60分钟后加入10 µL氧化剂储备溶液 (10×)(共 100 µL)。
为了成像,将板置于显微镜下,置于设置为37 °C和5% CO2的孵育室中。每孔以20倍放大率拍摄四张图像。在任何治疗前以 5 分钟的间隔首先采集四张RBC基线图像。添加抗氧化剂后,板以10分钟间隔成像六次(60分钟孵育)。在用氧化剂处理后,最终每小时拍摄20张延时图像。随访共持续1275分钟(21h15)。
Marzhauser显微镜电动平台用于GBR/GTR 阻隔膜的研究
MDPI的一篇文章报道了MarzhauserWetzlar显微镜电动平台用于GBR/GTR 阻隔膜的研究,文章名为Barbeck, M.; Kühnel, L.; Witte, F.; Pissarek, J.; Precht, C.; Xiong, X.; Krastev, R.; Wegner, N.; Walther, F.; Jung, O.Degradation, Bone Regeneration and Tissue Response of an Innovative Volume Stable Magnesium- Supported GBR/GTR Barrier Membrane. Int. J. Mol. Sci. 2020, 21, 3098.
汉堡大学(Universität Hamburg)发表的这篇文章的中文标题可以翻译为:创新的体积稳定镁支撑 GBR/GTR 阻隔膜的降解、骨再生和组织反应。生物可吸收胶原蛋白屏障膜用于防止软组织过早生长,并允许骨再生。生物可吸收胶原蛋白屏障膜用于防止软组织过早生长,并允许骨再生。对于体积稳定的适应症,目前只有不可吸收的合成材料可用。本研究调查了一种新的生物可吸收氢氟酸(HF)处理的镁(Mg)网,用于体积稳定的情况。材料和方法:在直接和间接的细胞相容性试验中,比较了HF处理的和未处理的镁。在体内,18只新西兰白兔分别接受了4个8毫米的小腿骨缺损,并被分为四组:(a)HF处理的镁网/胶原膜,(b)未处理的镁网/胶原膜(c)胶原膜和(d)假手术。6、12和18周后,用放射学和组织学方法测量镁的降解和骨的再生。结果。在体外,HF处理的Mg显示出更高的细胞相容性。在组织病理学上,HF-Mg可以防止气穴,并且在12周内被单核细胞通过吞噬作用降解。未经处理的Mg显示出部分明显的更多的气穴和纤维组织反应。所有组之间的骨再生没有明显的差异。讨论和结论。嵌入本地胶原蛋白膜的HF-Mg网片代表了一种体积稳定和生物相容性好的非吸收性合成材料的替代品。HF-Mg显示出较少的腐蚀,并被吞噬作用所降解。然而,膜的应用并没有带来更高的骨再生率。
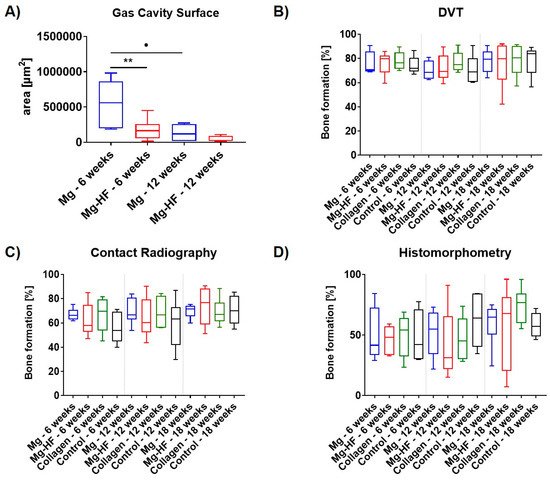
组织形态学分析包括对再生骨量的比较测量,这是在20倍放大率下使用Zeiss 47 52 69光镜(Carl Zeiss Microscopy GmbH, Jena, Germany)和一个校准的刻度进行测量的。此外,还对与镁质网格有关的空腔的大小进行了组织形态学测量。简而言之,所谓的 "总扫描 "是借助于专门的扫描显微镜产生的,该显微镜由Axio Scope.A1(卡尔-蔡司显微镜有限公司,德国耶拿)与数码相机和显微镜自动扫描台(Märzhäuser,德国Wetzlar)组成,与运行Zen Core软件(蔡司,日本东京)的PC系统相连。所得到的图像由100至120张单张图像组成,放大率为100倍,分辨率为2500×1200像素,包含整个种植区和种植体周围的组织。为了对空腔进行组织形态学测量,用甲苯胺蓝染色的玻片被数字化。这些图像可以通过Zen Core软件来测量空腔的大小。