

作者:维尔克斯 时间:2024-3-30 11:10:32
在许多神经退行性疾病(阿尔茨海默氏症和帕金森氏症)中,体内的蛋白质聚集在一起,产生所谓的“淀粉样蛋白”或“原纤维”。这些长链蛋白质形式可以在大脑中积累,破坏细胞功能。蛋白质从正常状态(单体)到疾病状态(中枢神经系统淀粉样蛋白沉积和原纤维形成)形成聚集体尽管关于淀粉样蛋白和原纤维是否是阿尔茨海默病的原因存在争议,但症状通常与它们的存在相关。因此,检测这些类型的蛋白质结构可能是早期诊断和治疗疾病的关键一步。
Vinita Mittal博士和她的团队首先在牛血清白蛋白溶液中开发原纤维。为了确认原纤维的存在,他们最初使用原子力显微镜拍摄了以下图像:普通的“单体”蛋白、中间相“低聚物”、最后是丝带状原纤维。在通过显微镜确认了三种蛋白质类型后,研究人员随后使用美国Block Engineering的LaserTune红外可调谐量子级联激光器扫描了每种类型。
蛋白质中的MIR吸收主要是由于多肽骨架(也称为酰胺带)的振动而发生的。酰胺I、Ⅱ和Ш波段的波长在5-10um之间,用作二级蛋白质结构的标记。酰胺峰可以通过光谱反褶积分析来研究蛋白质及其聚集体的结构。这些变化可以通过研究酰胺带的线形和相对吸光度,使用中红外MIR吸收光谱来诊断和监测。Vinita Mittal博士团队在MIR波长5.2-10μm(1900 -1000cm-1))的锗硅(GOS)波导上演示了蛋白质在三个聚集阶段的MIR光谱:牛血清白蛋白(BSA)蛋白的单体、低聚物和原纤维。
在通过显微镜确认了三种蛋白质类型后,研究人员随后使用Block Engineering的LaserTune红外可调谐量子级联激光器扫描了每种类型。他们主要关注酰胺I(1600-1700 cm-1,5.88-6.25μm)、酰胺II(1480-1580 cm-1,6.33-6.76μm)和酰胺III(1200-1300 cm-1,7.69-8.33μm)中红外区域的波段。这些波长范围对蛋白质的光谱特征特别敏感。在由此产生的扫描中,他们能够检测到三种蛋白质形式中每一种的吸收峰和频率的可测量偏移。单体、低聚物和原纤维之间的明显区别在化学特征中很明显。
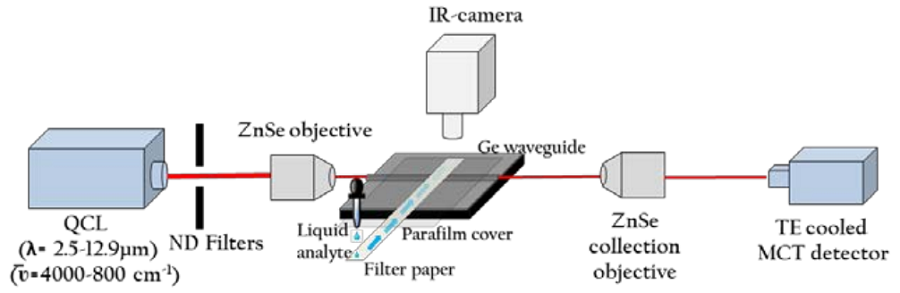
使用Block Engineering量子级联激光器(QCL),在波长为5.3 -12.9μm范围内可调谐作为光源和两个硒化锌(ZnSe)物镜用于输入和输出耦合。在获取透射光谱之前,将OCL设置为12.9μm,对准后在红外相机(XenicsGobi 640)上对波导输出进行成像。单体、低聚物和原纤维的光谱清晰地显示了它们在5.26-10μm之间的MIR区域的酰胺I、II和III吸收峰。观察到酰胺I和酰胺II峰的吸收频率、吸收强度和线形的变化,可以潜在地用于区分凝聚形成的三个阶段,并有助于临床相关神经退行性疾病的早期诊断。
尽管说形式的大小和组成可能是一些吸收差异的原因,但这些结果仍然有望在神经退行性疾病中早期鉴定蛋白质标志物,区分健康单体和团块原纤维的能力可能有助于检测这些疾病。使用美国Block Engineering QCL来识别与阿尔茨海默氏症和帕金森氏症相关的生物标志物,也将逐渐成为生命科学领域的一种趋势。